Saturs
- Elektronu skaits valences apvalkā
- 1. solis
- 2. solis
- 3. solis
- 4. solis
- Lūisa struktūra
- 1. solis
- 2. solis
- 3. solis
- Formāls katra atoma lādiņš
- 1. solis
- 2. solis
- 3. solis
Nosakot tādas molekulas kā CoCl2 (fosgēna gāze) formālo lādiņu, jāzina elektronu skaits katra atoma valences slānī un molekulas Lewis struktūra.
Elektronu skaits valences apvalkā
1. solis
Meklējiet katru atomu periodiskajā elementu tabulā, lai noteiktu elektronu skaitu valences apvalkā.
2. solis
Atcerieties, ka divi elektroni atrodas pirmajā apakšlīmenī s, divi ir otrajā apakšlīmenī s, seši elektroni pirmajā apakšlīmenī p utt. Atcerieties: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
3. solis
Sasitiet slodzi. Ja molekula ir jons, pievienojiet vai atņemiet vienu vai vairākus elektronus no kopējā daudzuma, lai iegūtu galīgo lādiņu.
4. solis
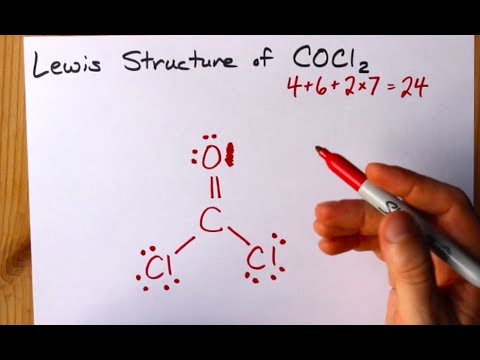
CoCl2 (fosgēna gāze): C = 4; O = 6; Cl = 7. Molekula nav jonizēta, un tai ir neitrāls lādiņš. Tāpēc kopējais elektronu skaits valences apvalkā ir 4 + 6 + (7x2) = 24.
Lūisa struktūra
1. solis
Skatīt CoCl2 (fosgēna gāze) Luisa struktūras diagrammu. Lūisa struktūra ir visstabilākā un iespējamākā molekulas struktūra. Atomi tiek vilkti ar sapārotiem valences elektroniem; starp brīvajiem elektroniem veidojas saites, lai apmierinātu okteta likumu.
2. solis

Uzzīmējiet katru atomu un tā valences elektronus un pēc tam izveidojiet saites pēc nepieciešamības.
3. solis
Hlorīda atomiem ir vienkāršas saites ar oglekļa molekulu, savukārt skābekļa atoms veido dubultu saiti ar oglekli. Katrs galīgās struktūras atoms apmierina okteta likumu, un valences apvalkā ir astoņi elektroni, kas nodrošina molekulāro stabilitāti.
Formāls katra atoma lādiņš
1. solis
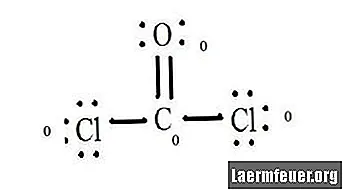
Saskaitiet katra atoma Lewis struktūrā bezelektronus. Katram atomam tiek piešķirts elektrons no katras saites, kurā tas piedalās. Pievienojiet šos skaitļus. CoCl2: C = 0 brīvie pāri plus 4 saišu elektroni = 4 elektroni. O = 4 brīvo pāru elektroni plus 2 saišu elektroni = 6 elektroni. Cl = 6 brīvo pāru elektroni plus viens saites ar C = 7 elektroni elektrons.
2. solis
Atņemiet nesaistītā atoma valences apvalka elektronu skaitu. Rezultāts ir formāla maksa par katru atomu. CoCl2: C = 4 valences elektroni (ev) nesaistītajā atomā mīnus 4 elektroni, kas norādīti Lūisa struktūrā (LS) = 0 formāls lādiņš O = 6 ev - 6 LS = 0 formāls lādiņš Cl = 7 ev - 7 LS = 0 formāla krava
3. solis
Rakstot, novietojiet šos lādiņus tuvu atomiem Lūisa struktūrā. Ja molekulai ir lādiņš kopumā, iekavās ievietojiet Lūisa struktūru ar augšpusē labajā stūrī uzrakstīto lādiņu.