Saturs
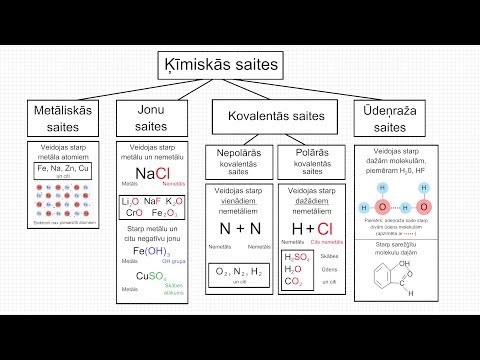
Jonu skaits savienojumā ir atkarīgs no savienojuma struktūras un tajā esošo elementu oksidācijas numuriem. Elementa oksidācijas numurs ir elektronu skaits, kam atoms ir vai ir vajadzīgs, salīdzinot ar to kodolu protonu skaitu. Tas nosaka atoma jonu lādiņu, kas ir būtisks, lai aprakstītu jonu savienojumus, ko tas veido ar citiem atomiem
Instrukcijas
-
Uzrakstiet attiecīgā savienojuma ķīmisko formulu.
-
Identificējiet polimātiskos jonus savienojumā. Poliomātiskie joni ir jonu molekulas, kas sastāv no vairāk nekā viena atoma (parasti vairāk nekā viens elements). Skatiet kopīgo polimātisko jonu un to lādiņu sarakstu.
-
Atdaliet katjonus un anjonus. Katjoni ir pozitīvi uzlādēti joni, anjoni ir negatīvi lādēti joni. Piemēram, FeSO (4) (dzelzs (II) sulfāts) satur dzelzs katjonu (Fe + 2) un anjonu sulfātu (SO (4) -2). Svarīgi atzīmēt, ka sulfāts ir polimātisks jons, nevis piecu dažādu jonu kopums. Romiešu skaitlis "II" norāda dzelzs +2 oksidācijas numuru. Tas ļauj tai saistīties tikai ar vienu sulfāta anjonu.
Ja ķīmiskajam simbolam ir ar to saistīts eksponents, savienojumā ir vairāki šī elementa atomi. Ja vien tie nav daļa no polomātiskā jona, katrs šī elementa atoms ir atsevišķs jonu. Piemēram, dzelzs (III) sulfāts ir rakstīts kā Fe2 (SO4) 3. Dzelzs oksidācijas skaitam +3 ir vajadzīgs atšķirīgs sulfātu skaits uz jonu savienojumu. Šajā gadījumā divi dzelzs (III) joni saistīsies ar trim sulfāta joniem.
-
Pievienojiet kopējo katjonu un anjonu skaitu. Piemēram, dzelzs (II) sulfātam ir divi joni: dzelzs katjons un sulfāta anjons.
Kā
- Visaptveroša izpratne par oksidācijas numuriem palīdzēs ātri un pārliecinoši atšifrēt savienojuma jonu raksturu.
Kas jums nepieciešams
- Periodiskā tabula